
扫码体验VIP

扫码VIP小程序
系统提示:股票复盘网只提供基本的股票信息,如果需要了解实时、详细的股票行情数据,请登录VIP复盘网..
|
创新医疗
002173 |
3.89%
|
最新:30.99
开盘:29.89 昨收:29.83 |
开盘%:0.2%
振幅%:4.26% 换手%:15.54% |
最高:31.15
最低:29.88 量比:1.59 |
总市值:137 亿
流通值:129 亿 成交额:4 亿 |
- 基本信息
- 主力分时图 New
- 股票百科
- 个股快讯
- 上市公司
- 更多股票
- 专家分析
- 龙虎榜
- 历史涨停原因
- 董秘互动
- 分时图
- 日K图
- 周K图
- 月K图
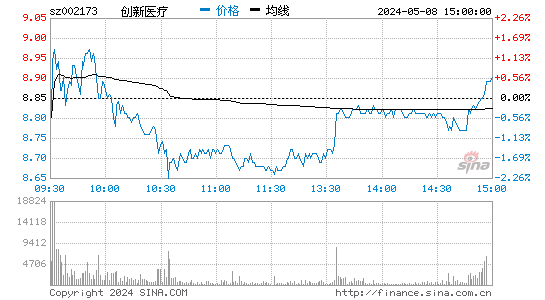
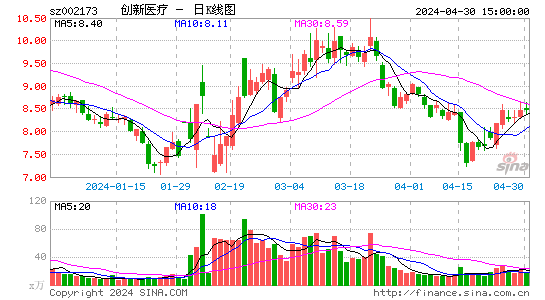
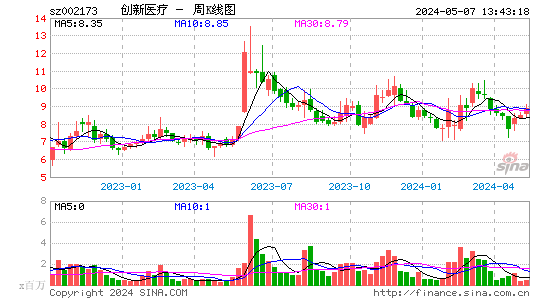
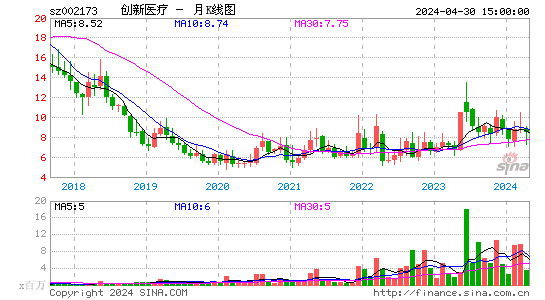
创新医疗股票概况
全面了解创新医疗及其股市表现
创新医疗股票概况
创新医疗是一家专注于医疗健康领域的上市公司,其股票在资本市场上备受关注。近年来,随着医疗健康产业的蓬勃发展,创新医疗股票也成为了众多投资者关注的焦点。
公司业务与优势
业务领域:创新医疗涵盖了医疗服务、医疗器械、健康管理等多个领域,致力于为患者提供全方位、高品质的医疗健康服务。
技术创新:公司注重技术创新和研发投入,不断推出新产品、新技术,提升医疗服务水平和患者满意度。
市场拓展:创新医疗积极拓展国内外市场,通过合作与并购等方式,扩大业务规模和市场份额。
股市表现与投资价值
创新医疗股票在资本市场上表现出色,股价稳定上涨,为投资者带来了可观的回报。同时,公司具备良好的盈利能力和成长性,投资价值凸显。
市场前景与挑战
随着人口老龄化、健康意识提升等因素的推动,医疗健康产业将迎来更加广阔的发展前景。然而,创新医疗也面临着行业竞争加剧、政策调整等挑战。
总结
创新医疗作为医疗健康领域的佼佼者,其股票具有较高的投资价值。未来,随着公司的不断发展和市场的不断拓展,创新医疗有望迎来更加辉煌的明天。
{summary}
创新医疗是一家专注于医疗健康领域的上市公司,涵盖多个业务领域,注重技术创新和市场拓展。其股票在资本市场上表现出色,具有较高的投资价值。未来,创新医疗将迎来更加广阔的发展前景。{/summary}
2026-02-27 11:22
【国家药监局:2025年共收到创新医疗器械特别审批申请457项】2月27日电,国家药监局发布2025年度创新医疗器械等产品注册审批情况,2025年,国家药监局按照《创新医疗器械特别审查程序》《医疗器械优先审批程序》继续做好相关产品的审查工作,共收到创新医疗器械特别审批申请457项,其中104项获准进入创新医疗器械特别审查程序;收到优先申请38项,其中26项获准优先审批。
2026-02-06 20:09
【央山医疗完成数千万元Pre-A轮融资】6日讯,近日,口腔手术机器人企业央山医疗完成数千万元Pre-A轮融资,本轮由山蓝资本、远毅资本领投,蓝驰创投跟投。央山医疗成立于2023年,以机器人、人工智能及无源类创新医疗器械为工具,为口腔及颌面外科手术提供全流程解决方案。根据创投通—执中数据,以2026年2月为预测基准时间,后续2年的融资预测概率为52.32%。
2026-02-06 07:43
【早知道:我国科学家在可扩展量子网络研究方面取得重大突破;美股三大指数集体收跌】2月6日电,A股2026年春节休市安排公布;商务部:研究出台专项政策,进一步提升进口贸易便利化水平;中药工业高质量发展实施方案印发;国家药监局:精准支持创新医疗器械发展 聚焦重点实现突破;国家发改委:做好2026年春耕及全年化肥保供稳价工作;我国科学家在可扩展量子网络研究方面取得重大突破;海南推“零关税”新政:岛内居民每年享受一万元进口商品免税额度;欧洲央行:维持三大关键利率不变,符合市场预期;美股三大指数集体收跌,纳指跌1.59%。
2026-02-05 16:06
【国家药监局:精准支持创新医疗器械发展 聚焦重点实现突破】2月5日电,国家药监局消息,2月4日至5日,2026年全国医疗器械监督管理工作会议在沈阳市召开。会议对2026年医疗器械监管工作部署六项重点任务:一是协力推进“十五五”规划编制工作,系统谋划工作部署,科学设定发展目标;二是构建更加完善的法规制度标准体系,积极推进立法进程,持续完善制度设计;三是精准支持创新医疗器械发展,持续释放政策红利,聚焦重点实现突破;四是推动医疗器械注册备案工作提质增效,深化规范治理,保持尺度统一;五是全方位治理安全风险,提升风险会商运行质效,持续以问题导向加强监管,严惩重处违法行为;六是全面提升监管专业能力水平,深入开展国际交流合作,积极构建共治新格局。
2026-02-05 14:32
【涉及脑机接口技术等,中国提出多项APEC合作项目】记者今天从广州召开的2026年亚太经合组织(APEC)标准与合格评定分委会(SCSC)首次会议了解到,此次会议由中方担任主席,市场监管总局牵头组织。中国在会议上提出的多项APEC合作项目,得到各个经济体的积极响应。其中聚焦脑机接口技术在康复领域的应用需求,推动APEC数字康复相关标准与测试技术区域协调,完善脑机接口ISO国际标准体系。提出数字赋能绿色转型新项目倡议,聚焦人工智能、区块链、物联网等先进技术在应对气候变化领域的应用潜力,推动ISO绿色低碳国际标准在APEC经济体实施。(央视新闻)
2026-02-05 12:14
【国家药监局:2025年获批上市创新医疗器械76个 同比增长17%】2月5日电,2026年全国医疗器械监督管理工作会上介绍,2025年我国医疗器械创新升级、接续发力。统计显示,2025年批准上市创新医疗器械76个,同比增长17%,累计批准391个;优先审批上市医疗器械25个,同比增长212.5%,累计批准171个。
2026-02-05 10:29
5日讯,截至发稿,科创板N北芯涨超194%。该股发行价为17.52元/股。公司主要从事心血管疾病精准诊疗创新医疗器械研发、生产和销售。
2026-02-05 07:59
【今日申购指南及新股定位分析】2月5日电,今日无新股申购;有1只新股上市,为科创板的北芯生命。北芯生命是国内领先的心血管精准诊疗创新医疗器械企业。
2026-01-29 17:06
【创新医疗:预计2025年净亏损2600万元-3300万元】1月29日电,创新医疗(002173.SZ)公告称,预计2025年归属于上市公司股东的净利润为-3300万元至-2600万元,上年同期为-9395.40万元。业绩变动主要系增持博灵脑机股权确认投资收益、建华医院收到法院返还被执行款项确认营业外收入;同时因医保政策调整,康华医院、建华医院递延所得税资产确认减少,导致所得税费用上升。
2026-01-29 10:16
【民政部:推动大语言模型、脑机接口等技术在残疾儿童康复领域的应用】民政部日前印发《关于进一步推进民政科技创新的指导意见》。其中提出,推进康复辅助器具、殡葬等领域技术创新。加强康复辅助器具科技攻关,研究精准神经调控、人机协同控制等关键技术,研发外骨骼机器人、智能矫形器、智能假肢、精神障碍患者康复辅助器具等技术装备和产品;研发康复辅助器具适配对象能力数字化评估技术,研究质量检测方法和标准规范,研制检测设备,完善康复辅助器具检测评估体系。推动大语言模型、脑机接口等技术在残疾儿童康复领域的应用,加强脑瘫、孤独症等残疾儿童康复技术和设备研发。加强殡葬服务全过程相关技术研究,研发新型绿色生态环保遗体处置技术,研制绿色低碳、智能化殡葬用品和遗体保存运输设备,推动遗体和遗物祭品处置技术设备迭代升级,实现殡葬领域碳减排;开展遗体防腐整容、殡葬污染物协同控制、殡仪场所消毒与生物学污染综合控制等技术研究,建立污染物防治技术体系。
2026-01-26 21:27
【爱舍伦:拟增资摩洛哥孙公司】1月26日电,爱舍伦公告,为强化海外市场战略布局,公司拟使用自有资金和自筹资金由香港子公司EXCELLENTMEDICALTECHNOLOGYCO.,LIMITED向摩洛哥孙公司增加1,500万欧元投资额(即总投资额不超过2,000万欧元),加快摩洛哥孙公司创新医疗的生产基地建设。
2026-01-26 07:48
【今日申购指南及新股定位分析】1月26日电,今日有1只新股申购,为科创板的北芯生命;无新股上市。北芯生命是国内领先的心血管精准诊疗创新医疗器械企业。
2026-01-22 11:57
【深圳:推动商业健康保险与医疗、医保、医药协同发展】深圳市地方金融管理局发布《深圳市关于保险业助力科技创新和产业发展的行动方案(2026—2028年)(征求意见稿)》。其中提出,丰富生物医药保险产品,支持开发医药和医疗器械研究开发综合保险、创新药和创新医疗器械研发中断保险、医疗卫生机构科技成果转化综合保险、人体临床试验责任保险、创新药和创新医疗器械产品责任保险、创新药和创新医疗器械走出去费用损失保险等保险品种。支持保险机构与健康产业链、生物医药行业的深化合作,推动商业健康保险与医疗、医保、医药协同发展。在风险可控、商业可持续的前提下,稳步探索将医疗新技术、新药品、新器械纳入商业健康险保障范围。
2026-01-22 08:12
【中信证券:医保新政出台 医疗器械迎来行业性投资机遇】1月22日电,中信证券研报表示,国家医保局发布新政,制定手术机器人与外科手术耗材相关服务价格立项指南,手术机器人在国内的推广和普及速度有望加快。同时国家医保局表示立项指南未来将持续扩容,利好整体创新医疗器械产品。我们强烈建议投资者重视医疗产业链投资机遇,综合梳理两条投资主线:一、重点关注手术机器人行业及上下游产业链(含腔镜机器人、骨科机器人、神经外科机器人);二、推荐关注微创外科、骨科、消化内科、心血管科、神经内科等高值耗材行业。
2026-01-21 19:21
【上海浦东去年地区生产总值预计1.88万亿元左右 增速高于全市】1月21日电,上海市浦东新区第七届人民代表大会第六次会议1月21日开幕,浦东新区区长吴金城作政府工作报告。吴金城介绍,2025年,浦东经济社会发展稳中有进、进中提质。一是经济韧性增长。预计地区生产总值1.88万亿元左右、增速高于全市,规模以上工业总产值1.39万亿元、同比增长8%,外贸进出口总额2.76万亿元、同比增长5.9%,一般公共预算收入1343.1亿元、同比增长2.6%。二是新质生产力动能强劲。预计集成电路、生物医药、人工智能三大先导产业规模分别达到3500亿元、4400亿元和1800亿元,总规模增长8.3%。8个国产1类新药、6个三类创新医疗器械获批上市,累计44个大模型通过备案;新增上市企业7家,科创板上市企业累计53家,占全国8.8%。三是改革开放释放活力。引领区建设、浦东新区综合改革试点、自贸试验区高水平制度型开放等国家战略任务总体落地率超过95%,累计170项经验做法在全国复制推广;预计浦东国际机场货邮吞吐量突破400万吨、港口集装箱吞吐量达到5011万标箱;新增跨国公司地区总部23家、各类首店208家。
2026-01-20 21:31
【创新医疗:董事拟减持公司不超0.0873%股份】1月20日电,创新医疗(002173)1月20日公告,持股0.3492%的董事阮光寅拟减持公司不超38.52万股,即不超公司总股本的0.0873%
2026-01-20 19:17
【国家医保局首次明确机器人手术收费指引】1月20日电,国家医保局1月20日正式印发《手术与治疗辅助操作类医疗服务价格项目立项指南(试行)》,为机器人手术、远程手术辅助等创新医疗技术统一价格立项。最新发布的指南规范形成了37项价格项目、5项加收项、1项扩展项,覆盖医学3D重建、生物3D打印、术中显微成像、手术路径导航、计算机体层扫描引导、手术机械臂、远程手术等多个领域的辅助操作费。国家医保局称,为确保机械臂手术、远程手术的质量可控和可追溯,立项指南将“医疗数据、设备运行记录的存储上传”纳入价格构成,医疗机构开展医学3D重建、手术路径导航、手术机械臂、远程手术等辅助操作时,应保存并上传符合要求的医疗数据和设备运行记录,未提供数据存储和上传服务的,将执行减收政策。 (第一财经)
2026-01-12 21:09
【公告精选:多只商业航天热门股提示风险;潮宏基等多家公司业绩大幅预增】1月12日电,【热点】卓创资讯:发行H股备案申请材料获中国证监会接收。志特新材:将核查股票交易波动情况,13日起停牌。上纬新材:如未来股价进一步上涨,将进一步申请停牌核查。航天环宇:如未来股价进一步异常上涨, 可能申请停牌核查。银河电子:公司股价短期涨幅较大,存在非理性炒作风险。华秦科技:公司主要收入来源于航空发动机产业领域。信科移动:卫星互联网领域收入占比2%—3%,对公司业绩无重大影响。智明达:商业航天嵌入式计算机对公司营收贡献存在不可预见性。*ST铖昌:商业航天行业处于产业初期阶段,公司基本面未发生重大变化。中衡设计:2025年1—9月“商业航天”相关项目累计确认收入占比约0.39%。盛洋科技:子公司FTA布局国外卫星互联网终端业务,该业务仍处商业化初期。震有科技:2025年前三季度卫星互联网领域收入占比约7.15%。再升科技:目前“高硅氧纤维产品”暂无在手订单。豪能股份:公司航天零部件业务收入规模极小。航天科技:公司股价存在大幅上涨后回落风险。邵阳液压:目前公司产品未直接服务商业航天领域客户。顺灏股份:投资轨道辰光事项对公司2025年经营业绩影响较小。东方通信:卫星互联网网络维护业务营收占比不到1%。恒为科技:公司不涉及AI应用相关业务。蓝色光标:现阶段AI驱动相关收入占公司整体营收比重较小。引力传媒:公司GEO业务尚未形成相关收入。值得买:与MiniMax合作事项对公司当前主营业务未构成实质性影响。创新医疗:博灵脑机产品赛博灵科AC5于2025年实现收入11.4万元。天银机电:控股股东在股票异动期间减持124.53万股。西部材料:公司股价短期涨幅较大,可能存在非理性炒作。华是科技:筹划公司控制权变更事项,13日起停牌。江化微:筹划公司控制权变更事项,13日起停牌。世茂能源:筹划公司控制权变更事项,继续停牌。ST易事特:1月14日起撤销其他风险警示。*ST名家:撤销因重整而被实施的退市风险警示,继续实施其他风险警示。*ST岩石:2025年度业绩预亏,公司股票可能被终止上市。四创电子:被暂停参加全军物资工程服务采购活动资格。闻泰科技重大资产出售进展:印度业务资产包交易存在争议。唯特偶:与七腾机器人签订战略合作协议。老板电器:拟向优特智厨增资1亿元,共同深耕智能炒菜机器人市场。【再融资】鑫科材料:拟向控股股东定增募资不超3.5亿元。金溢科技:终止向特定对象发行股票。【并购】中原环保:拟收购新泓公司、格沃公司100%股权。盛达资源:拟2.695亿元收购广西来宾金石矿业55%股权。蓝箭电子:拟收购成都芯翼不低于51%股权,向芯片设计产业链拓展。【经营业绩】潮宏基:2025年净利润同比预增125%—175%。亚太股份:2025年净利润同比预增120%—170%。药明康德:预计2025年净利润同比增长约102.65%。藏格矿业:2025年净利润同比预增43.41%—53.1%。容百科技:预计2025年第四季度单季度扭亏为盈。永辉超市:预计2025年度业绩亏损。三安光电:预计2025年度亏损2亿元至4亿元。上港集团:2025年净利润134亿元,同比下降10.4%。新集能源:2025年净利润20.64亿元,同比下降13.73%。圣农发展:2025年12月销售收入18.61亿元,同比增长11.03%。合富中国:2025年合并营收6.89亿元,同比下降26.67%。唐山港:2025年预计完成货物吞吐量同比增长4.1%。京能电力:2025年累计完成发电量同比下降3.09%。【增减持&回购】恒实科技:控股股东拟增持公司1.5%—3%股份。凯普生物:实控人王建瑜增持400万股,拟继续不低于1200万元增持。天益医疗:拟6000万元—1.2亿元回购股份。佰维存储:国家集成电路基金二期拟减持公司不超2%股份。海波重科:实控人张海波拟减持公司不超2.98%股份。国安达:实控人及其一致行动人拟合计减持公司不超3%股份。卓越新能:控股股东拟减持公司不超3%股份。钧达股份:控股股东拟减持公司不超3%股份。恒帅股份:控股股东减持公司可转债57万张。信维通信:实控人拟减持公司不超1%股份。百川股份:副总经理郑江拟减持公司不超0.65%股份。赛分科技:股东拟合计减持公司不超6%股份。趣睡科技:特定股东拟合计减持公司不超2.58%股份。【中标合同】铁科轨道:中标5.11亿元高速铁路扣件项目。华电科工:中标唐山港约3.73亿元斗轮堆取料机项目。大龙地产:控股子公司预中标7.63亿元建筑施工项目。立中集团:子公司获客户项目定点,预计销售总额约8.2亿元。【其他】沪电股份:拟3亿美元投建高密度光电集成线路板项目。甬矽电子:拟不超21亿元投建马来西亚集成电路封装和测试生产基地。金龙羽:拟约12亿元投建年产2GWh固态电池量产线项目。金盘科技:新产品非晶带材部分产线一次投产成功。海翔药业:与万邦德制药签订创新药合作协议。棕榈股份:拟转让两家项目公司股权抵偿债务,抵债金额2.58亿元。
2026-01-12 19:37
【创新医疗:博灵脑机产品赛博灵科AC5于2025年实现收入11.4万元】1月12日电,创新医疗(002173)1月12日发布股票交易异常波动公告称,公司关注到目前市场对公司脑机接口业务关注度较高。公司控股子公司博灵脑机(杭州)科技有限公司(简称“博灵脑机”)成立于2021年年初,并于2025年8月被公司纳入合并报表范围,当前产品主要用于脑血管疾病患者(以中风偏瘫为主)在医疗机构进行康复训练以及出院后在居家情况下的运动功能辅助和增强。博灵脑机产品赛博灵科AC5已于2025年10月正式上市销售,2025年共实现收入11.4万元;赛博灵科AM5已完成多中心临床试验,2025年尚未实现收入。2023年、2024年,博灵脑机的经营亏损分别为660.17万元、866.41万元。
2026-01-12 18:56
【创新医疗:博灵脑机产品赛博灵科AC5已于2025年10月正式上市销售 2025年共实现收入11.40万元】1月12日电,创新医疗(002173.SZ)发布股票交易异常波动公告称,公司关注到目前市场对公司脑机接口业务关注度较高。公司控股子公司博灵脑机(杭州)科技有限公司(以下简称“博灵脑机”)成立于2021年年初,并于2025年8月被公司纳入合并报表范围,当前产品主要用于脑血管疾病患者(以中风偏瘫为主)在医疗机构进行康复训练以及出院后在居家情况下的运动功能辅助和增强。博灵脑机产品赛博灵科AC5已于2025年10月正式上市销售,2025年共实现收入11.40万元;赛博灵科AM5已完成多中心临床试验,2025年尚未实现收入。2023年、2024年,博灵脑机的经营亏损分别为660.17万元、866.41万元。
2026-01-12 18:52
创新医疗:公司关注到目前市场对公司脑机接口业务关注度较高。公司控股子公司博灵脑机产品赛博灵科AC5已于2025年10月正式上市销售,2025年共实现收入11.40万元;赛博灵科AM5已完成多中心临床试验,2025年尚未实现收入。2023年、2024年,博灵脑机的经营亏损分别为660.17万元、866.41万元。
2026-01-12 14:53
【脑机海河实验室:在航空航天领域开发五代空间站在轨脑机交互系统,完成人类首次“太空脑机接口实验”】1月12日电,脑机交互与人机共融海河实验室今日官微消息,日前,由工业和信息化部主管、中国电子信息产业发展研究院主办期刊《新型工业化》刊发脑机交互与人机共融海河实验室主任、天津大学副校长明东署名文章《打通技术链 补全人才链 促进脑机接口科技成果转化应用》。明东提到,天津大学脑机交互与人机共融海河实验室团队聚焦无创脑机接口领域,持续推动科技创新与产业化落地。目前,已形成从高性能的器件、芯片、算法、平台,到系统集成和关键底座与应用集于一体的全链条布局。在临床应用领域,天津大学研制的“神工”脑机交互创新医疗器械全谱系产品相继问世,逐步覆盖脑卒中康复、脊髓损伤运动辅助、抑郁诊疗、听觉障碍诊疗等临床场景应用。在航空航天领域,设计开发五代空间站在轨脑机交互系统,完成人类首次“太空脑机接口实验”,并相继在后续多次载人飞行任务中取得重要应用,服务于航天员功能状态与情绪状态等精准检测,实现了航天员的效能增强,为我国载人航天工程的新一代医学与人因保障系统提供关键技术支撑。
2026-01-12 14:53
【脑机海河实验室:在航空航天领域开发五代空间站在轨脑机交互系统,完成人类首次“太空脑机接口实验”】1月12日电,脑机交互与人机共融海河实验室今日官微消息,日前,由工业和信息化部主管、中国电子信息产业发展研究院主办期刊《新型工业化》刊发脑机交互与人机共融海河实验室主任、天津大学副校长明东署名文章《打通技术链 补全人才链 促进脑机接口科技成果转化应用》。明东提到,天津大学脑机交互与人机共融海河实验室团队聚焦无创脑机接口领域,持续推动科技创新与产业化落地。目前,已形成从高性能的器件、芯片、算法、平台,到系统集成和关键底座与应用集于一体的全链条布局。在临床应用领域,天津大学研制的“神工”脑机交互创新医疗器械全谱系产品相继问世,逐步覆盖脑卒中康复、脊髓损伤运动辅助、抑郁诊疗、听觉障碍诊疗等临床场景应用。在航空航天领域,设计开发五代空间站在轨脑机交互系统,完成人类首次“太空脑机接口实验”,并相继在后续多次载人飞行任务中取得重要应用,服务于航天员功能状态与情绪状态等精准检测,实现了航天员的效能增强,为我国载人航天工程的新一代医学与人因保障系统提供关键技术支撑。
2026-01-12 14:38
【脑机接口概念股午后持续走强,南京熊猫6天5板】1月12日电,脑机接口概念股午后持续走强,南京熊猫6天5板,道氏技术涨停,创新医疗、诚益通、三博脑科、翔宇医疗、美好医疗、伟思医疗跟涨。
-
VIP复盘工具
- 更多复盘工具
- 股票复盘百科
-
股票复盘知识
- 揭秘股市龙头股的技术特征与市场逻辑
- 股票上涨后的卖出策略:智慧与时机的较量
- 可转债:天堂与地狱的交界,理性投资的关键
- 揭秘大宗交易平台:机构投资者背后的秘密战场
- 融资融券账户现金还款全攻略
- 股票如何建仓及短线操作建仓技巧
- 专业操盘手的股市制胜策略:深度解析五大法则
- 如何在牛市中稳健前行:五点核心策略
- 股市迷思:为何“懂点皮毛”的股民最易亏损?
- 长短信号融合:精准捕捉市场动态,规避指标失灵策略
- 股市风云:掌握四大能力,抗衡投资风险
- 股市浮沉录:泪满巾的启示
- 新手炒股必备:跨越五大关卡,迈向投资高手之路
- 跌势中选股的精妙技巧
- 弱市中的淘金术:反其道而行之的投资策略
- 揭秘涨停板的奥秘:如何识别“好板”
- 警惕空方占优,智取股市解套策略
- 揭秘股市涨跌停板:智慧投资,规避圈套
- 散户晋级之路:揭秘短线炒股高手的选股策略与实战技巧
- MACD指标的实战运用:精准捕捉买卖时机
当前版本:V3.0

 VIP复盘网
VIP复盘网
